Dernière modification le 9 février 2023
Vous connaissiez le circuit cérébral de la récompense ? Voici celui de l’effort

Sébastien Bouret, Sorbonne Université
« Allez, encore un effort, tu y es presque ». Nous avons tous entendu cette phrase, et vécu cette sensation d’effort. Quand il est question de serrer les dents et de trouver l’énergie et de faire un effort pour atteindre ce but qu’on s’était fixé. On savait que ce serait difficile, mais on décide de le faire malgré tout. Et au moment d’agir, il faut trouver les ressources pour atteindre l’objectif fixé.
Comment cela se passe-t-il ? Quels mécanismes permettent de faire cet effort ? Cette question est essentielle, puisque la gestion de l’équilibre entre les coûts et les bénéfices est cruciale pour la survie de tous les animaux. On peut donc imaginer que les processus neurobiologiques et comportementaux impliqués dans la régulation de cet équilibre occupent une place centrale. Mais encore faut-il les identifier !
La recherche en neurosciences comportementale propose un processus très simple pour la gestion de l’effort : dans un cadre utilitariste, la quantité d’énergie fournie pour l’action est proportionnelle à la récompense attendue à l’issue de cette action, selon un processus appelé motivation incitative, dans lequel la dopamine joue un rôle central.
La dopamine est produite par un petit groupe de neurones situés dans les profondeurs du cerveau, dans des régions assez anciennes sur le plan phylogénétique. Ces neurones dopaminergiques (DA) innervent les régions antérieures et dorsales du cerveau, impliquées dans le contrôle moteur (et la dégénérescence ce ces neurones DA dans dans la maladie de Parkinson est responsable des symptômes moteurs). Mais ils innervent également des régions ventrales, impliqués plus directement dans la motivation, pour constituer avec elles ce qu’on appelle parfois le « circuit de la récompense ».
Le rôle crucial de la dopamine dans la motivation incitative a largement été démontré : d’une part les neurones dopaminergiques sont activés par des informations sur la récompense, et leur niveau d’activation est proportionnel à la valeur de la récompense attendue. Plus la récompense attendue est plaisante, plus l’activation des neurones est importante. D’autre part la perte de l’innervation dopaminergique (soit dans des cas pathologiques chez l’homme, soit de façon expérimentale chez l’animal en laboratoire) induit une diminution de la motivation incitative : l’influence positive de la récompense sur l’intensité de l’action diminue.
Par exemple, si on entraîne un animal a sauter une barrière pour obtenir une récompense, on observe que les animaux sont prêts à sauter plus haut quand la récompense est plus grande. Quand on bloque le système dopaminergique, la hauteur qu’ils sont prêts à sauter pour une même récompense diminue : on a bloqué la capacité de la récompense à énergiser l’action. En d’autres termes, la dopamine permet de travailler plus quand on peut gagner plus.
La dopamine explique-t-elle tout ?
Mais est-ce que c’est bien ça l’effort ? Ou plutôt, est-ce que la dopamine et la motivation incitative peuvent rendre compte de tous les aspects de l’effort ?
Au premier abord, ce système permet d’équilibrer les dépenses avec les bénéfices puisque la dépense énergétique est ajustée en fonction des bénéfices attendus. Mais subjectivement, la question de l’effort se pose justement quand on doit faire face à une difficulté. En d’autres termes, on doit pouvoir rendre compte des situations où justement on fait l’effort, on dépense de l’énergie surtout en fonction de la difficulté envisagée, et moins du bénéfice attendu (ou du moins pas directement).
Nous avons donc formulé l’hypothèse selon laquelle il existe un système spécifique à la gestion de l’effort. Ce système serait mobilisé pour fournir de l’énergie directement en fonction du coût escompté, c’est-à-dire de la performance recherchée sachant la difficulté attendue. Intuitivement, quand la difficulté augmente, il faut faire plus d’effort pour maintenir une bonne performance. Mais quand la difficulté est grande, on peut aussi bien « ne pas faire d’effort », c’est-à-dire se contenter d’une performance médiocre et réaliser ainsi une économie d’énergie. Et c’est typiquement pour arbitrer ce type de décision que nous pensons qu’il existe un système propre à l’effort. En d’autres termes, le système d’effort permettrait de réguler l’énergie non pas en fonction des bénéfices attendus (ou du moins pas directement), mais plutôt du rapport entre la difficulté et la performance attendue. Mais au-delà de ces questions théoriques, un tel système cérébral propre à l’effort existe-t-il vraiment dans le cerveau ?
Tout d’abord, des études récentes suggèrent que le système dopaminergique aurait un rôle limité dans la gestion de l’effort, quand on peut séparer l’influence des coûts potentiels des niveaux de récompense potentielle sur le comportement (ce qui n’est pas le cas dans les expériences où la taille de la récompense est proportionnelle à la force exercée). En effet, l’activité des neurones DA reflète principalement les informations sur la récompense : elle augmente avec la taille de la récompense et sa probabilité d’obtention.
Bien que le risque ou le délai puisse être considéré comme des coûts, ils n’impliquent pas nécessairement une dépense énergétique supplémentaire, et donc un effort. En revanche, l’activité des neurones DA diminue assez peu avec le niveau de force à exercer pour obtenir la récompense. Ainsi, le système dopaminergique est sensible aux bénéfices (quantité, probabilité et délai) mais il n’est pas sensible aux coûts (quand ceux-ci correspondent à une dépense énergétique). Par ailleurs, la plupart les expériences qui ont étudié le rôle du système dopaminergique dans la production d’effort ont utilisé des taches comportementales dans lesquelles la récompense était couplée à l’effort, de telle sorte qu’un déficit de production d’effort est indissociable d’un déficit de traitement de la récompense. Ainsi, si un sujet produit moins de force quand on bloque son système dopaminergique dans ce type de tâche, cette diminution de force pourrait être interprétée soit en termes de déficit de production d’effort (mesuré avec la force) soit en termes de déficit de sensibilité à la récompense.
Si l’on reprend les expériences décrites plus haut, où les animaux doivent sauter une barrière dont la hauteur est proportionnelle à la récompense promise, les animaux dont on bloque le système DA pourraient préférer les petites barrières pas parce qu’ils sont plus sensibles à la difficulté (parce que leur gestion de l’effort est altérée) mais parce qu’ils sont moins sensibles à la récompense, et donc que le bénéfice associé aux grandes barrières n’est plus suffisant pour leur donner envie de sauter.
Mais est-ce qu’il existe un autre système capable de gérer l’effort directement, sans passer par la récompense associée ?
Il y a plusieurs années, pendant mon stage postdoctoral aux USA j’enregistrais l’activité des neurones du Locus Coeruleus, un petit noyau du tronc cérébral dont les neurones produisent de la noradrénaline et innervent presque tout le reste du cerveau. Nous étudiions la motivation en demandant à des singes (macaques rhesus, Macaca Mulatta) de faire une tâche très simple, dans laquelle ils devaient exécuter des séries d’actions pour obtenir une récompense.
Ma collègue Sabrina Ravel étudiait les neurones dopaminergiques et elle montrait que leur activité était plus grande quand les animaux effectuaient une action récompensée que quand ils n’étaient pas récompensés. Or pour les neurones noradrénergiques du locus coeruleus, c’était le contraire : leur activation était plus intense quand les animaux réalisaient une action non récompensée, un peu comme s’ils étaient liés à l’effort que devaient faire les animaux pour exécuter cette action pour rien (en fait pour progresser dans la série d’essai qui, au final, leur permettait d’obtenir une récompense).
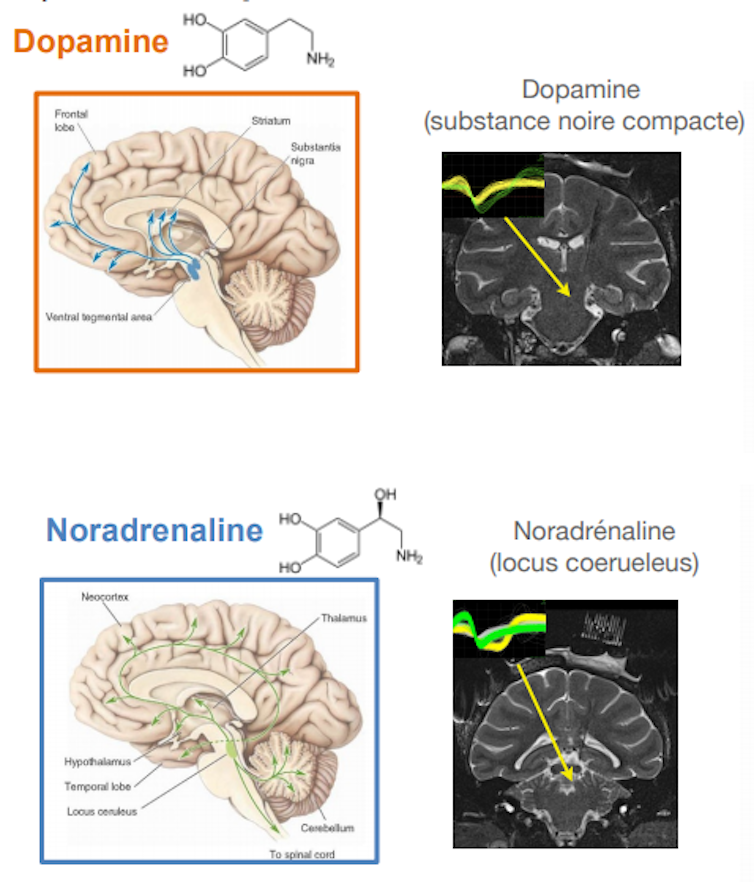
Pour approfondir cette question, il était nécessaire de manipuler directement l’effort. De retour à Paris, avec Chiara Varazzani qui a fait sa thèse sous ma direction, nous avons entraîné des singes à effectuer une tâche dans laquelle les animaux devaient réaliser un effort physique (appuyer sur une pince, en exerçant plus ou moins de force). Et là encore, les neurones du LC étaient plus actifs quand les animaux devaient réaliser une action moins bien récompensée, mais surtout quand l’effort à faire était plus important. Plus la force à exercer sur la pince était grande, plus l’activité des neurones du locus coeruleus était importante au moment où les singes décident d’appuyer sur le levier. Ces mêmes neurones étaient par ailleurs activés pendant que les animaux serraient la pince. Un peu comme si ces neurones s’activaient à chaque fois que les singes devaient faire un effort, soit pour exercer une force plus grande (effort physique) soit pour se résoudre à effectuer une action plus difficile et/ou moins bien récompensée (effort mental).
Nous avons donc proposé que le système noradrénergique jouait un rôle crucial dans la gestion de l’effort, et complémentait le rôle du système dopaminergique dans la gestion de la récompense. Mais pour valider cette hypothèse, il était nécessaire de tester le lien de causalité entre les niveaux de noradrénaline dans le cerveau et la gestion de l’effort. Il fallait aussi s’assurer que le système noradrénergique était bien lié à l’effort tel que nous l’avions défini, c’est-à-dire la mobilisation d’énergie pour faire face à une difficulté. En d’autres termes, le système noradrénergique doit permettre d’assurer la performance choisie en fonction de la difficulté attendue. Il fallait donc utiliser une tâche comportementale qui manipule directement ces processus et isoler l’effet de la récompense de l’effet de l’effort.
Nous avons entraîné des singes à effectuer une tâche dans laquelle ils devaient choisir entre 2 options, caractérisée chacune par un certain niveau et force et un certain niveau de récompense. Pour réaliser cette tâche, les animaux sont confortablement installés face à un écran d’ordinateur et leur cage est équipée de 2 poignées (droite et gauche). À chaque nouvel essai de la tâche, on associe à chaque côté (droite vs gauche) un niveau de force à exercer sur la poignée un niveau de récompense (nombre de gouttes de jus), et ces informations sont affichées sur l’écran en face du singe. Pour isoler l’influence de l’effort de celle de la récompense sur les choix, ces deux paramètres sont manipulés indépendamment et aléatoirement.
L’animal utilise les informations
Ainsi, à chaque essai, l’animal utilise les informations sur le niveau d’effort et de récompense de chacune des options et sélectionne l’option (droite ou gauche) qui minimise l’effort et/où qui maximise la récompense. Il doit bien entendu exercer le niveau de force choisi sur le levier correspondant pour valider l’essai et obtenir la récompense associée. Nous pouvions donc évaluer l’effort ressenti par les singes à travers 2 mesures : 1) les choix (combien l’effort envisagé paraît coûteux, et donc à éviter) et 2) l’exécution de l’action (à quel point les animaux font l’effort d’exercer la force choisie). L’effort tel que nous l’avons défini doit donc affecter ces 2 mesures, puisqu’il permet de relier la difficulté envisagée (mesurée avec les choix) et l’énergie investie pour assurer la performance (mesurée par la force exercée). Une fois entraînés, les animaux sont capables de réaliser plus de cent essais par jour, avec une sensibilité comparable pour l’effort et la récompense.
Nous avons ensuite utilisé une approche pharmacologique pour manipuler les niveaux de noradrénaline, et évaluer son implication dans la gestion de l’effort. Nous avons donc comparé le comportement des animaux entre deux conditions expérimentales : dans l’une, les animaux reçoivent une injection « témoin » de sérum physiologique. Dans l’autre, on injecte aux singes une faible dose de clonidine, une drogue qui abaisse les niveaux de noradrénaline dans le cerveau. À cette dose de clonidine, l’abaissement des niveaux de noradrénaline n’affecte ni la vigilance des singes ni leurs capacités motrices. En revanche, comparativement à la condition témoin, les choix des animaux sous clonidine sont plus orientés vers les petites forces, et la force qu’ils investissent dans l’action est moins importante. De plus, les effets de la drogue sur les choix et sur la force exercée sont corrélés (à travers les sessions de test) ce qui renforce l’idée que la noradrénaline contrôle bien un processus central (l’effort), qui influence à la fois les choix et la performance.
Surtout, les effets de la clonidine sont spécifiques à l’effort puisque la sensibilité des animaux à la récompense est identique entre les deux conditions expérimentales. Grâce un modèle mathématique qui permet de capturer les effets complexes des différents processus motivationnels en jeu dans cette tâche, nous avons pu confirmer que la noradrénaline joue un rôle central et spécifique dans la gestion de l’effort, défini ici comme un processus d’allocation d’énergie pour assurer la performance en fonction de la difficulté attendue.
L’ensemble de ces travaux confirme l’existence d’un système cérébral propre à l’effort, dans lequel la noradrénaline joue un rôle crucial. Ce système serait complémentaire du système DA impliqué dans la gestion de la récompense et son influence sur le comportement (motivation incitative). Mais pour aller plus loin dans la compréhension de la façon dont le cerveau gère l’effort, il faudra identifier les autres structures impliquées dans ce système cérébral de l’effort et caractériser la dynamique de leurs interactions. Par ailleurs, le système cérébral de l’effort semble impliqué non seulement dans la gestion de l’effort physique (les actions) mais aussi, et peut être surtout, l’effort mental (le contrôle des actions). En effet, l’effort implique plus un contrôle du comportement (décider d’agir, malgré les coûts, ou plus simplement arbitrer entre plusieurs actions possibles) plus que son exécution (la contraction musculaire). Cette question reste difficile et pour l’approfondir cette question, il sera crucial de combiner des approches théoriques et expérimentales. La recherche continue !![]()
Sébastien Bouret, Chargé de recherche CNRS, Sorbonne Université
Cet article est republié à partir de The Conversation sous licence Creative Commons. Lire l’article original.
Spécialiste de la gestion du stress et des compétences comportementales depuis près de 25 ans.
Master Spécialiste en Sophrologie Caycédienne, instructeur de méditation, de PNL et formatrice.
Ces différentes techniques me permettent d’accompagner des Entreprises, des Individuels et des Institutions dans la mise en place de programmes adaptés à leurs objectifs. Ces programmes et protocoles sont proposés en présentiel, en distanciel ou en full digital sous le format de WEB’Ateliers.
Contactez – moi par WhatsApp
Vous retrouverez des informations plus spécifiques sur tous ces sujets sur les sites http://apprivoisersonstress.fr ou https://sophrologie-au-quotidien.com
